
Consiste em determinar a concentração de uma solução, pela reação com outra solução de concentração conhecida. Podemos dizer que a titulação é a principal operação da chamada análise volumétrica ou volumetria realizada em laboratório, onde a solução padrão (concentração conhecida) contida em uma bureta é misturada gota a gota na solução problema (concentração desconhecida) existente em um erlenmeyer. A solução problema deve apresentar algumas gotas de indicador para determinar o final da titulação, em virtude da mudança de cor da mesma.
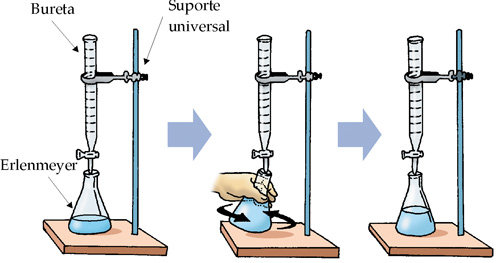
O ponto final da titulação é conhecido como ponto de viragem. Como a titulação consiste de uma reação entre o soluto da solução padrão e o soluto do problema, os problemas devem ser resolvidos por estequiometria.
Exemplo
Retiramos, com auxílio de uma pipeta, 50 mL da solução contida no frasco abaixo, (observe que a solução possui concentração molar desconhecida) e transferimos para um frasco erlenmeyer.
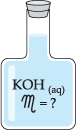
No frasco erlenmeyer, contendo a solução básica, adicionamos algumas gotas de fenolftaleína, um indicador que, na presença de base, adquire a coloração avermelhada.
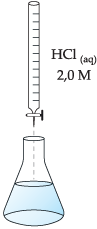
Com o auxílio de uma bureta (figura a seguir), adicionamos cautelosamente à solução contida no erlenmeyer uma solução de HCl(aq) 2,0 M.
Assim, no erlenmeyer haverá a seguinte reação, representada pela equação.
1 HCl(aq) + 1 KOH(aq)  1 KCl(aq) + 1 H2O(l)
1 KCl(aq) + 1 H2O(l)
Pela equação, observaremos que a neutralização entre o ácido e a base será completa quando o número de mols de
Esse fato é verificado exatamente no momento em que a coloração vermelha, devido ao meio básico, muda para incolor. Neste momento, o número de mols
Anotamos o volume de ácido gasto (25 mL), e calculamos quantos mols do ácido foram utilizados para reagir completamente com a base.
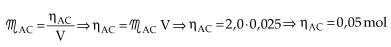
Vejamos agora como se calcula a concentração molar do KOH(aq):
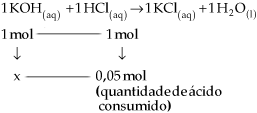
x = quantidade em mols de OH– presente no erlenmeyer = 0,05 mol
Assim, para calcular a concentração molar da base:
Exercício resolvido
Por lei, o vinagre (solução aquosa de ácido acético) pode conter, no máximo 4% em massa (0,67 mol/L) de ácido acético. Para você verificar se o vinagre utilizado em sua casa atende às especificações legais, para isso você verifica que 40 mL de vinagre são neutralizados por 8 mL de solução aquosa de NaOH 2 M. A que conclusão você chegou?
Dados:
Vinagre: V = 40 mL = 0,04 L, [ác. acético] = ? (mols/L)
NaOH(aq): V = 8 mL = 0,008 L, [NaOH] = 2 mols/L
RESOLUÇÃO
Cálculo do número de mols de NaOH que reage:
2 mols de NaOH → 1 L de solução
X → 0,008 L de solução
X = 0,016 mol
Cálculo do número de mols de ác. acético que será neutralizado pelo NaOH:
CH3-COOH + NaOH → CH3-COO-Na+ + H2O
1 mol 1 mol
X 0,016 mol
X = 0,016 mol
Cálculo da [ác. acético] no vinagre:
0,016 mol de ác. acético → 40 mL de vinagre
X → 1000 mL de vinagre (1 L)
X = 0,4 mol, com isso temos que: [ác. acético] = 0,4 mol/L
Como a concentração de ác. acético máxima exigida por lei, no vinagre, é de 0,67 mol/L, com isso concluímos que a amostra de vinagre analisada não atende às especificações exigidas.
Alguem poderia me ajudar a resolver esses dois problemas de titulaçoes?
ResponderExcluir1) Para a padronização de uma soluçao de hidroxido de sodio com acido acetico 0,15mol/l utilizou se 10ml da soluçao amostra.Considerando que a soluçao amostra tem uma concentração de 15g/L,qual vai ser o volume (mL) da soluçao padrao que vamos ocupar?
2) Em uma titulaçao de neutralização de uma amostra de hidroxido de amonio com uma soluçao padrao de acido sulfurico 0,15mol/L foram realizados 4 titulaçoes com os seguintes gastos da soluçao padrao:1ªtitulaçao:20 mL 2ªtitulaçao: 20,1mL 3ªtitulaçao: 20,1mL 4ª titulaçao 20mL.Nas titulaçoes a amostra foi medida com uma pipeta volumetrica de 25 mL.O ponto de equivalencia da titulação foi localizado atraves do uso de fenolftaleina .Qual é a concentração da amostra de hidroxido de amonio em g/L,e ppm?